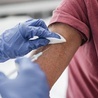
Szczepionka Pfizera pozytywnie zaopiniowana przez Europejską Agencję Leków do użytku w UE
Badanie wykazało też "skuteczność szczepionki na poziomie ok. 95 proc. u osób zagrożonych ciężkim przebiegiem COVID-19, w tym u osób z astmą, przewlekłą chorobą płuc, cukrzycą i wysokim ciśnieniem krwi". Została też dopuszczona przez Komisję Europejską do użycia na terenie UE.
EMA (Europejska Agencja Leków) zdecydowała o autoryzacji szczepionki przeciwko COVID-19 firm Pfizer i BioNTech. Na podstawie tej decyzji Komisja Europejska wydała jeszcze w poniedziałek zgodę na użytkowanie preparatu na terenie Unii Europejskiej.
Jak podkreśla szefowa EMA Emer Cooke, ocena naukowa Agencji opiera się na sile dowodów naukowych dotyczących bezpieczeństwa, jakości i skuteczności szczepionki; dowody w przekonujący sposób pokazują, że korzyści są większe niż ryzyko.
- Chcemy, aby obywatele decydowali o szczepieniach na podstawie faktów; EMA opublikuje informacje na temat oceny, w tym wszystkie dane kliniczne ocenione we wniosku; umożliwi to dalszą niezależną kontrolę naukowców - zaznaczyła Cook.
Szczepionka przeciw COVID-19 firm BioNTech i Pfizer, która otrzymała autoryzację, nosi nazwę Comirnaty. Badanie wykazało skuteczność szczepionki na poziomie ok. 95 proc. u osób zagrożonych ciężkim przebiegiem COVID-19, w tym u osób z astmą, przewlekłą chorobą płuc, cukrzycą i wysokim ciśnieniem krwi. Nie ma też na tym etapie dowodów na to, że szczepionka miałaby być nieskuteczna wobec nowego szczepu koronawirusa SARS-CoV-2, który wykryto w ostatnim czasie w Wielkiej Brytanii.
Równocześnie podkreślono, że w badaniach klinicznych nie wzięła udział wystarczająco duża liczba kobiet, by wydawać zdecydowane rekomendacje; oznacza to, że decyzje dotyczące podawania szczepionki kobietom w ciąży będą musiały być podejmowane indywidualnie, na podstawie indywidualnej oceny ryzyka.
EMA zaleciła dopuszczenie szczepionki do użycia u osób od 16. roku życia wzwyż.
Agencja poinformowała, że najczęstsze działania niepożądane związane ze stosowaniem szczepionki były zwykle łagodne lub umiarkowane i ustępowały w ciągu kilku dni po szczepieniu. Wskazała, że obejmowały one ból i obrzęk w miejscu zastrzyku, zmęczenie, ból głowy, bóle mięśni i stawów, dreszcze i gorączkę.
Preparat ma być podawany w formie dwóch zastrzyków w ramię, wykonanych w odstępie co najmniej 21 dni.
EMA podała, że bezpieczeństwo i skuteczność szczepionki będą nadal monitorowane w miarę jej stosowania w państwach członkowskich Unii Europejskiej.

Terroryzm w Afryce to „narastające globalne zagrożenie”

Alfy, zetki i kasa w Kościele. Zakonnice i zakonnicy szkolą się na forum w Kokotku
2-letni chłopiec mógł przebywać pod wodą nawet kilkanaście minut. Udało się go wybudzić!